Entretien avec Marine Siwiaszczyk doctorante du projet Neuro2Co
Publié par Elodie Chaillou, le 8 mai 2019 2.9k
Quel est votre parcours de formation ?
J’ai obtenu un bac S puis une licence de biologie à l’université de Limoges, où j’ai suivi une deuxième année de Biochimie, Biologie Moléculaire, Cellulaire et Génétique et ensuite je me suis orientée en L3 en licence de Biologie Cellulaire et Physiologie. Dans cette formation j’ai découvert les neurosciences qui m’ont beaucoup intéressée, j’ai donc souhaité continuer dans ce domaine. Je suis alors venue à Tours pour suivre les cours du master 1 en biologie santé avec parcours neurosciences puis le M2 en Cognition, Neurosciences et Psychologie. J’ai effectué mon stage de master1 avec Elodie Chaillou et Scott Love de l’équipe Comportement, Neurobiologie, Adaptation sur le thème de la nomenclature manuelle du cortex de mouton. Mon stage de Master 2 s’est déroulé dans l’équipe Autisme, à l’hôpital Bretonneau de Tours, sur les fonctions oculomotrices au cours du développement normal et autistique. J’y ai utilisé la technique de l’eye-tracking qui permet le suivi du regard. Cette technique consiste à diffuser à des enfants des simulations sur écran pour vérifier divers paramètres afin d’identifier des différences dans le traitement des informations visuelles chez les enfants avec troubles autistiques par rapport aux enfants à développement typique.
Votre premier travail sur le mouton correspondait à quoi ?
L’objectif était de créer un atlas anatomique du cortex de mouton identifiant chaque circonvolution et chaque sillon. Cet atlas permet de se repérer dans le cortex, comme avec un plan ou une carte routière.
Les chercheurs ne disposaient-ils pas déjà d’une cartographie du cerveau de mouton ?
Oui, il en existe même plusieurs.
De nombreux travaux ont été réalisés sur la cartographie de neuromédiateurs, de neuropeptides ou de récepteurs dans des structures cérébrales de mouton. Mais ces travaux ne donnent qu’une information partielle. Toujours à l’échelle cellulaire, il existe un site internet (https://msu.edu/~brains/brains/sheep/index.html) qui met à disposition des images de coupes colorées et légendées. Plus récemment, l’usage de l’IRM a permis d’accéder à l’encéphale entier en 3D. Sur la base de ces images, il existe plusieurs atlas volumiques. Toutefois, pour les régions corticales, la stratégie que nous avons retenue de construire un atlas « surfacique » n’avait pas encore été utilisée.
L’image du cerveau est faite de circonvolutions, de reliefs…
Oui. La surface de l’encéphale, appelée cortex, présente chez le mouton, comme chez les primates, des creux et des bosses. Les creux sont appelés sillons ou sulci, et les bosses sont appelées circonvolutions ou gyri. Et comme il s’agit de latin, au singulier on parle d’un sulcus et d’un gyrus !
Qu’est-ce qu’on l’on délimite ? En quoi consiste la segmentation ?
En analyse d’images, la segmentation consiste à délimiter des zones, des régions, des objets… en utilisant des critères objectifs.
Pour mon stage de M1, j’ai travaillé sur des images anatomiques d’encéphale de brebis acquises par IRM à la plateforme Cire (UMR PRC, Inra Val de Loire). A partir de ces images, nous avons réalisé une reconstruction de la surface du cerveau à l’aide du logiciel, FreeSurfer. Il s’agit en quelque sorte de gonfler virtuellement le cerveau pour qu’il devienne lisse, ce qui permet de faire apparaitre les sulci à plat en surface, et de segmenter automatiquement les gyri et les sulci auxquels sont attribuées des couleurs différentes : gris clair pour les gyri et gris foncé pour les sulci. Sans cette méthode, il serait très difficile d’évaluer la profondeur réelle des sillons.
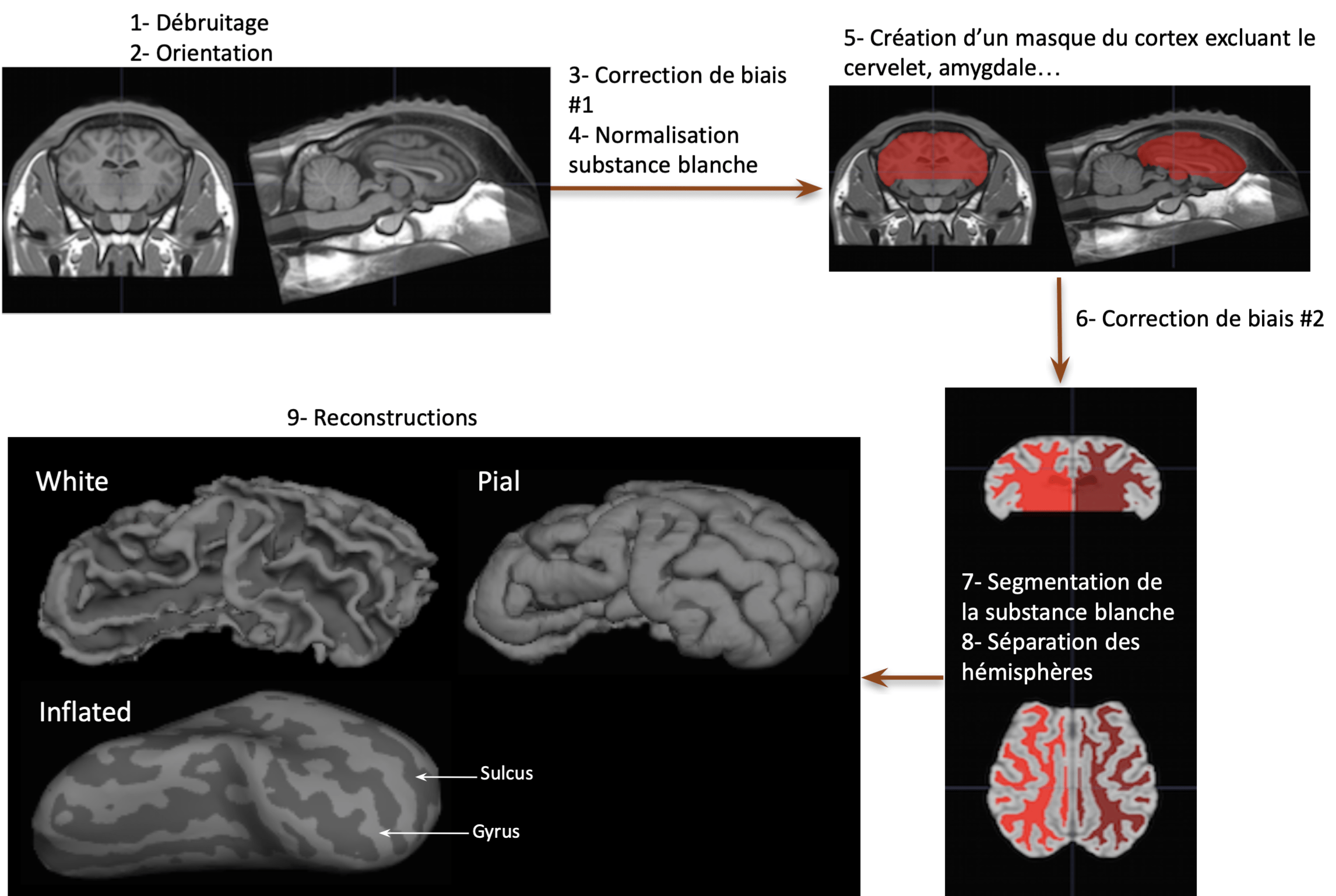
Mon travail a ensuite consisté à segmenter manuellement et à nommer chaque gyrus et chaque sulcus en m’aidant de travaux scientifiques publiés.
Comment avez-vous procédé pour nommer les zones délimitées ?
Nous nous sommes basés sur une publication ancienne (Landacre, 1930)qui proposait une nomenclature faite à partir de dessins anatomiques, alors qu’aujourd’hui nous travaillons à partir d’images d’IRM ce qui est très différent.
Nous nous sommes aussi inspirés de la nomenclature vétérinaire, afin d’avoir des noms cohérents par rapport aux autres espèces mammaliennes. Nous avons ensuite fait des choix quant aux termes, car parfois, en fonction des publications, une structure peut posséder plusieurs noms différents.
En ce qui concerne les délimitations, nous avons décidé de ne pas diviser certaines régions en sous-régions. En effet, dans certaines nomenclatures, un gyrus peut être divisé en trois parties alors que sur l’image IRM une seule est visible. Dans ces cas, nous avons choisi de suivre les images IRM et de ne délimiter qu’une seule région.
Vous avez observé beaucoup de régions différentes ?
J’ai retrouvé une vingtaine de gyri et autant de sulci. Il s’agissait de les comptabiliser et de leur donner des noms. Cette nomenclature existe chez l’Homme mais pas chez le mouton alors que l’on travailler de plus en plus sur ce modèle animal. Il était donc important de trouver un consensus sur les appellations.
La terminologie est-elle la même chez le mouton et l’Homme ?
Tout dépend de la région considérée. Par exemple, pour la plupart des structures sous-corticales, la terminologie est la même quelle que soit l’espèce mammalienne. Ce n’est pas forcément le cas pour les régions corticales. Chez l’Homme, certaines d’entre elles sont dénommées par leur fonctionnalité, comme le cortex moteur, et/ou par le nom de leur découvreur, comme l’aire de Wernicke impliquée dans la compréhension du langage. Chez le mouton, certaines régions corticales ont pu être fonctionnellement délimitées (cas du cortex moteur) et d’autres non. Dans mon travail, nous avons fait le choix d’utiliser une terminologie universelle qui ne tient pas compte de la fonction mais uniquement de l’anatomie (gyri, sulci) et de la localisation sur le cortex. Pour cela, nous nous sommes appuyés sur des descriptions réalisées chez le cochon, le chat ou l’âne.
Les noms des zones du cerveau doivent-ils être écrits en latin ? Cette question reste en suspens car l’anglais est le plus souvent usité aujourd’hui en sciences. Dans notre cas, nous avons privilégié l’usage du latin comme dans la nomenclature vétérinaire.
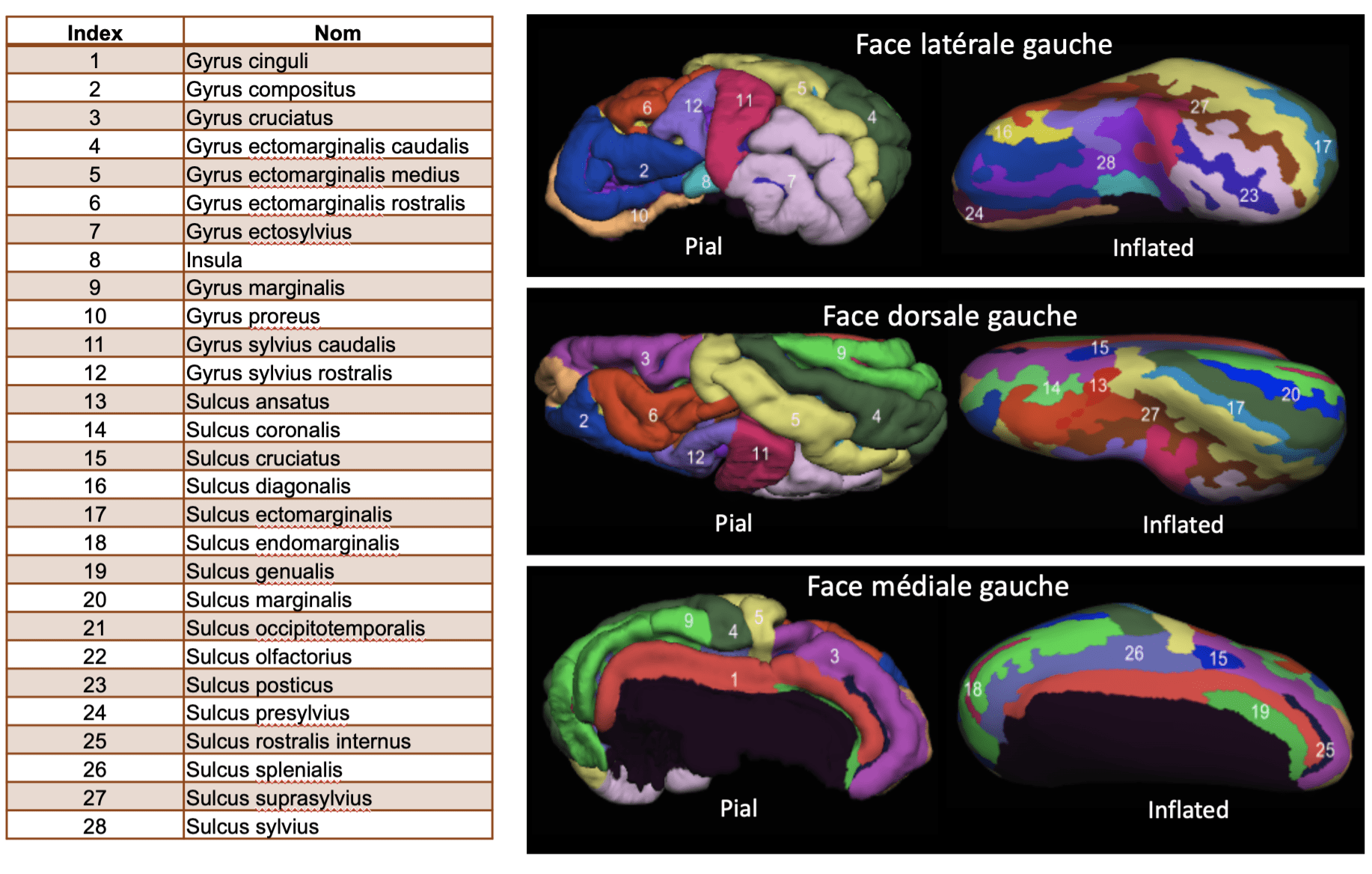
Après le Master 2 vous avez cherché à effectuer une thèse ?
Oui pendant dix mois en France et à l’étranger. J’ai été contactée par Elodie Chaillou et Scott Love, avec qui j’avais réalisé mon stage de Master 1, pour un CDD de 24 mois d’assistant ingénieur dans le cadre du projet Neuro2Co, qui relève aussi des sciences participatives. Finalement, pour assurer le suivi du projet sur toute sa durée, un des collaborateurs, Beauval Nature, a apporté son soutien financier pour permettre de convertir le CDD en bourse de thèse. Ce fut une super opportunité pour moi ! Je connaissais déjà le labo depuis le stage M1, qui s’était bien passé, et le projet de thèse m’intéressait. J’ai donc commencé ma thèse dans l’équipe Neuroéthologie & Développement des Comportements Socioémotionnelsen mai 2018 pour 3 ans.
Qu’est-ce qui vous amené à travailler en neurosciences ? Quelle a été l’étincelle ?
C’est toujours un domaine qui m’a intéressée, je regardais ça de loin, j’ai toujours voulu travailler dans les sciences sans vraiment savoir ce que c’était. Je suis allée directement en faculté de biologie après le bac et j’ai fait mon parcours un peu au fur et à mesure des découvertes.
J’avais toujours dans un coin de ma tête l’idée de travailler dans les neurosciences mais sans en avoir fait et sans savoir si cela pouvait me plaire. En troisième année de licence j’ai été très intéressée par la façon dont le cerveau gère tant de choses, son rôle de contrôle primordial pour un organe si petit par rapport au corps humain.
En quoi consiste votre participation au projet Neuro2Co ?
Je suis en thèse pendant trois ans et j’étudie les connectomes de la substance grise périaqueducale chez différentes espèces animales. Le connectome de l’encéphale représente l’ensemble des connexions qui existent entre les structures cérébrales. L’hypothèse de ma thèse c’est que le connectome de la substance grise périaqueducale reflète les stratégies d’adaptation comportementale chez différentes espèces animales. Actuellement je travaille sur des images de cerveau de cailles de différentes lignées : une lignée de cailles émotive et une autre non émotive. Ces lignées sont issues d’une sélection génétique obtenue depuis de nombreuses années à l’INRA à l’aide d’un test comportemental d’immobilité tonique qui consiste à prendre une caille et à la poser sur le dos sur un support en bois en forme de U.On sépare en deux groupes celles qui restent longtemps sur le dos et celles qui se redressent assez rapidement. Les premières sont dites émotives et les secondes non émotives.
On a envoyé nos cailles à Neurospin (CEA, Saclay) où les cerveaux ont été imagés (http://joliot.cea.fr/drf/joliot/Pages/Entites_de_recherche/NeuroSpin.aspx). Sur ces images je délimite toutes les régions de l’encéphale de caille que je peux identifier. Ensuite je pourrai évaluer le nombre de connexions entre ces structures, plus précisément je vais extraire des cartes de connectivité pour chaque individu. Je pourrai alors les comparer entre les deux lignées et identifier les différences qui existent entre les deux lignées de cailles. Nous allons notamment étudier le circuit des émotions, voir si les connexions sont structurées de la même manière, ou non, entre les deux lignées.
La deuxième approche de mon projet de thèse évaluera l’impact du vécu de l'individu sur le connectome. Pour cela, je travaillerai sur le modèle ovin, en étudiant les connectomes de moutons élevés dans deux contextes différents.
Enfin, les recherches se font aussi en partenariat avec le zooparc de Beauval, qui nous fournit des pièces anatomiques prélevées lors de l’autopsie d’animaux décédés. Les encéphales sont envoyés à notre partenaire, NeuroSpin, qui réalise les acquisitions IRM à partir desquelles, nous pourrons décrire les connectomes d’animaux issus de la faune sauvage. Cela nous permettra de réaliser des études de biologie comparée, par exemple pour étudier les différences de connectomes entre des animaux « prédateurs » et des animaux « proies ».
Comment visualise-t-on ce connectome ? Comment voit-on ces liaisons et ces différences entre émotif et non émotif chez la caille ?
Nous réalisons des images IRM, avec des machines très puissantes à Neurospin (11.7 Tesla). Nous réalisons aussi des IRM de diffusion qui permettent de visualiser la diffusion des molécules d’eau le long des fibres blanches qui assurent les connexions dans le cerveau.
Dans le projet Neuro2Co il y a aussi la partie de collaboration avec le collège de Château-Renault ?
Oui, nous travaillons pour la deuxième année consécutive avec un groupe d’une quinzaine de collégiens (de la 5ème à la 3ème) lors des ateliers Ciboulot qui ont lieu tous les mardis midi. Les collégiens ont réalisé des segmentations sur des cerveaux de caille et de cerf-souris avec un logiciel, et c’était assez impressionnant parce qu’ils sont concentrés, comprennent très vite et sont très enthousiastes. Ils posent parfois des questions auxquelles on ne s’attend pas ce qui nous permet de réfléchir à de nouvelles hypothèses.

Que voient-ils concrètement à l’écran ?
Ils voient des images d’encéphale obtenues par IRM ! Lors des ateliers, les élèves ont appris à utiliser le logiciel ITK SNAP que j’utilise moi-même pour faire les segmentations.
Depuis le début du projet, je leur ai fourni des images IRM de cerveaux de cailles ou de cerf-souris. Pour le modèle caille, ils ont segmenté manuellement les yeux, l’encéphale entier ou le cervelet, en recherchant les différences de niveaux de gris entre deux régions.
Comment se fait la délimitation ?
La délimitation se fait comme si on faisait du coloriage à l’aide de notre souris d’ordinateur, mais sans connaître les limites précises des parties à colorier ! Les images IRM sont en 3D, le logiciel de segmentation permet de voir les différentes coupes de l’image dans les 3 plans : sagittal (de côté), horizontal (de dessus) et frontal (de face). Le but est de colorier, sur chaque coupe et dans les 3 plans, chaque région d’intérêt. A un contraste correspond une région. En effet, les images IRM ont des niveaux de gris (allant du noir au blanc), on considère donc que lorsque le contraste change, la région anatomique aussi.
Donc les collégiens ont bien intégré cette notion de relief ?
Oui, ils ont commencé par se familiariser avec cette notion en écrivant le mot IRM en 3D, chaque coupe étant à représenter d’une couleur différente. Ils ont ensuite continué dans le même esprit avec des segmentations sur des images réelles et l’utilisation de différentes couleurs, une par structure. Ils ont une bonne notion de ce qu’il faut délimiter ou pas et ils comprennent vite.
Et le logiciel a une fonction qui permet de visualiser les régions ainsi délimitées en 3D.
Quel avenir pour la suite des ateliers ?
Les participants à l’atelier vont continuer de segmenter les images de cerveaux de différents animaux, un des objectifs de nos travaux étant de comparer ce qu’ils segmentent avec ce que je segmente. Je suis censée être l’œil expert et eux l’œil novice et voir si l’on peut comparer nos deux observations. On ne leur donne pas de bornes précises des régions d’intérêt pour voir s’ils observent autre chose qu’un « expert » qui a déjà en tête la zone qui l’intéresse. Ils peuvent très bien trouver quelque chose de semblable ou de différent de ce que je peux faire : il n’y a pas de bonne ou mauvaise réponse.
Parallèlement à ce travail de recherche, les élèves assistent à des présentations thématiques en lien avec le projet, ils développent un projet pratique (les robots cailles, un connectome simulé en 3D) et deviennent eux-mêmes des médiateurs scientifiques pour la fête de la science ou pour la semaine du cerveau auprès des écoliers de Château-Renault.
Chaque année, les collégiens ont aussi la possibilité de visiter les laboratoires des différents partenaires du projet Neuro2Co : le centre INRA Val de Loire de Nouzilly où ils ont pu voir le vaste panel des métiers de la recherche, à NeuroSpin ils ont vu différents modèles d’IRM et à PolyTech Tours ils ont découvert de nouveaux robots ! Bref, des moments forts pour ces deux premières années ! Et d’autres surprises restent à venir !..
Propos recueillis par Laurent Cario (chargé de communication à l'Inra Centre Val de Loire)





